
点击上方蓝字关注,对浙大人很重要哦~


北京时间10月25日
浙江大学医学院郭江涛课题组和
基础医学系Dante Neculai教授团队的
两项科研成果
在国际顶尖杂志《科学》上刊登
你是不是很好奇
相关研究的具体内容
让我们一起继续往下看!


1浙大研究刊登《科学》
“看清”钾-氯共转运蛋白的结构,
为治疗癫痫提供新思路
人体细胞内的钾、钠、氯等离子稳态是受到严格调控的,离子稳态一旦失衡,就会导致高血压、抑郁、癫痫等一系列疾病。而在细胞膜上,有一类被称为阳离子-氯离子共转运蛋白的蛋白质,可以带着离子进入和离开细胞,从而有效调控细胞内的离子稳态。不过长期以来,由于缺乏精确的结构信息,人们对这类蛋白的工作机理还不甚了解。
近日,浙江大学医学院郭江涛课题组解析了这类蛋白质中的一个成员——人源钾-氯共转运蛋白KCC1的2.9埃的高分辨率冷冻电镜结构,揭示了钾离子和氯离子的结合位点,提出一个钾-氯共转运机理的模型,这将为相关的疾病治疗和药物设计提供新的视角。

团队成员郭江涛、叶升和刘斯在讨论课题
10月25日,这项研究刊登在国际顶级杂志《科学》(Science)上。浙江大学医学院刘斯博士、冷冻电镜中心常圣海博士和物理系硕士生韩斌铭为文章的共同第一作者。
为何雾里看花?
一般来说,人体细胞内的钾离子浓度是高于细胞外浓度的。钾-氯共转运蛋白KCC利用这个钾离子浓度梯度,将细胞内的钾离子和氯离子一起转运至细胞外,从而调控细胞内的氯离子浓度。
氯离子浓度是一个很关键的指标。例如,在γ-氨基丁酸介导的抑制性神经传递过程中,抑制性神经元需要维持细胞内较低的氯离子浓度才能发挥正常的抑制作用。正是由于钾-氯共转运蛋白中的一个成员KCC2不停地将细胞内的钾离子和氯离子转运至细胞外,使得抑制性神经元细胞内能够维持较低的氯离子浓度。如果KCC2发生突变,抑制性神经传递就会受到破坏,这样一来神经元会持续放电,从而引发各种神经系统疾病,如癫痫等。
既然KCC的功能如此重要,为何科研人员长久以来都没有揭开这个家族的面纱呢?
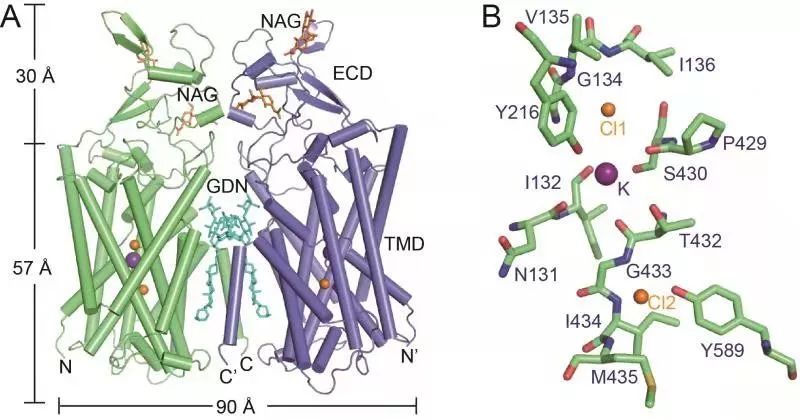
图为人源KCC1的结构。(A)KCC1的二聚体结构;(B)KCC1的钾离子与氯离子结合位点。
郭江涛研究员介绍说,这主要受限于两方面的因素。首先,钾-氯共转运蛋白的样品获得不容易。要想做结构研究,首先得有溶液状态下的大量、均一的蛋白样品。但因为钾-氯共转运蛋白在细胞内的本底含量很低,为了获得大量的蛋白样品,就需要将蛋白的基因包裹在杆状病毒中,用杆状病毒感染大量的哺乳动物细胞进行过量表达。在蛋白纯化过程中,由于钾-氯共转运蛋白是定位于细胞膜上的膜蛋白,具有很强的疏水性,在水溶液中膜蛋白不稳定,易于沉淀,需要溶解在双亲性的去污剂中。因此,钾-氯共转运蛋白的纯化和样品制备的过程比一般的水溶性蛋白更加复杂和困难。蛋白纯化过程就像是大浪淘沙,培养几升的细胞,经过逐步纯化,最终才获得100微克左右的蛋白样品。
另一方面,较小分子量的膜蛋白的高分辨率结构解析一直具有挑战性。如果采用传统的晶体学解析这种膜蛋白结构,通常需要花费几年的时间,而且就算投入大量的人力和经费,最终结果也往往不理想。近年来冷冻电镜技术的发展为解析膜蛋白结构提供了便捷的途径。不过,困难依旧存在。“冷冻电镜通常对分子量大于150千道尔顿(道尔顿为相对原子质量单位,1道尔顿的质量等于1克的6.02×1023分之一)的蛋白质的结构解析非常有效,分辨率往往在3.5埃左右(1埃等于1米的一百亿份之一);但对于小分子量蛋白质的高分辨率结构解析仍然比较困难。”郭江涛说,以KCC1为例,最终解析结构的部分的分子量只有120千道尔顿,分辨率为2.9埃,这对于一般的冷冻电镜结构生物学研究来说,是很不容易的。
飞越迷雾把你看清楚
刘斯经过大量的蛋白表达和纯化条件的优化,最终获得足够量的可用于冷冻电镜数据收集的KCC1蛋白样品。此时,浙江大学冷冻电镜中心的300 kv的高性能冷冻电镜Titan Krios派上了大用场。
然而,有先进的冷冻电镜,也不一定拍出好照片。生物大分子样品对曝光非常敏感,电子的辐射会让其受损伤。拍照只能在曝光时间短、剂量低的情况下进行,但这也直接导致了拍摄噪音大。“拍到理想的照片真可谓是一波三折,课题组的研究从2017年就开始了,但真正拿到高分辨结构已经是2019年初了。”常圣海说。

团队成员在分析结构数据
为了减少电子对蛋白的辐射损伤,蛋白样品需要在冷冻环境下进行数据收集。这又是个技术活。在数据收集前,科研人员用液态乙烷把蛋白溶液样品快速冷冻在一张“铜网”上。铜网的每个目下面是一个方格,里面有几百个通透的孔,蛋白颗粒就被玻璃态的冰层包裹在这些孔中。但是,问题又来了,一般的冰层厚度在100-200纳米之间,而KCC1蛋白的直径在8-10个纳米之间,就好像要在十几米深的泳池里寻找1米长的目标,噪音很大。
为了提高分辨率,刘斯和常圣海先是“削薄”冰层,然后再不断调整参数,让冷冻后的KCC1蛋白颗粒能够密集而均匀地分布在冰层较薄的区域。这样不仅可以显著降低冰层的噪音,提高分辨率,而且可以增加每张照片的蛋白颗粒数量,提高数据收集效率。
电镜数据收集的过程,有点像电影的拍摄手法:在8秒的时间内连续拍摄40张照片,形成一个“微电影”。科研人员通过图像处理,将微电影“叠加”成一张照片,这样可以显著提高照片的信噪比,获得更为清晰的画面。课题组从3000多部“微电影”中,挑出了一两百万个蛋白颗粒进行数据处理。经过层层筛选,最终用十万个左右的高质量的蛋白颗粒进行高分辨率三维重构。
课题组最终获得了两套2.9埃高分辨率的KCC1的三维结构。“这项工作首先得益于近年来的冷冻电镜技术的发展;刘斯和常圣海在蛋白样品制备和数据收集处理方面的经验和决心是课题取得进展的关键因素。”郭江涛这样评价道。
令人兴奋的发现
分析了KCC1的高分辨率三维结构后,研究人员发现KCC1是以二聚体的形式存在,它的跨膜区与胞外区均参与了二聚体的形成。在KCC1结构中,研究人员鉴定出一个钾离子和两个氯离子的结合位点;结合离子转运实验、分子动力学模拟、结构比较等方法,该研究阐明了KCC1以1:1的比例同时同向转运钾离子和氯离子的分子机理。
“阐明分子机理,不仅需要高分辨率三维结构,而且需要离子转运活性实验、分子动力学模拟进行验证。范德比尔特大学的Eric Delpire和浙大物理系的李敬源团队在这方面提供了专业的技术支持。”论文的资深作者叶升教授高度评价合作者的工作。
“物质的跨膜运输是人体细胞与外界进行物质、能量和信息交换的重要途径”,郭江涛介绍说,“在转运钾离子和氯离子的过程中,KCC1就好像细胞膜上有一个旋转门,朝内这一侧的门先打开,离子结合到KCC1上进入旋转门内;然后朝外这一侧的门打开了,离子从旋转门释放到细胞膜外。”
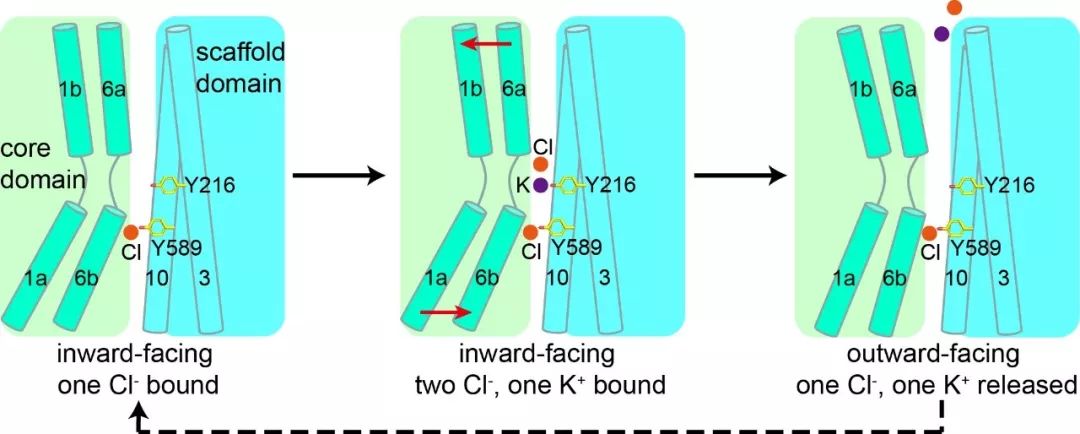
图为KCC1共转运钾离子和氯离子的模型。第二个氯离子首先结合在第二位点,然后钾离子和第一个氯离子结合;KCC1的构象由内向态向外向态转变,钾离子和第一个氯离子释放至细胞外。
获得了KCC1的高分辨率电镜结构,将有助于下一步设计针对KCC的药物,为治疗癫痫等疾病提供帮助。文章审稿人认为:“这项工作揭示了一个令人兴奋的人源转运蛋白的结构。”
这项研究的主体工作在浙江大学完成,浙江大学冷冻电镜中心为数据收集提供了大力支持。浙江大学医学院的郭江涛研究员整合了德克萨斯大学西南医学中心白晓辰团队、天津大学叶升团队、范德比尔特大学的Eric Delpire团队以及浙江大学物理系的李敬源团队等研究力量,体现了跨学科合作的优势。该工作还得到了浙江大学医学院杨巍教授、冷冻电镜中心主任张兴教授的帮助。该研究受到国家自然科学基金委、科技部重点研发计划等项目的资助。

2浙大学者《科学》刊文,
揭示两个重要蛋白
“欲谋其政须在其位”的奥秘
先天性免疫反应是人体防御外来病原体和应激物的第一道防线。这种快速非特异性的反应,依赖于模式识别受体对病原相关分子模式以及损伤细胞所释放的损伤相关分子模式的快速识别。
胞质中的NOD蛋白就是在血液和小肠这两大系统中的重要模式识别受体,其家族中的NOD1和NOD2是抗细菌免疫的关键模式识别受体,它们通过识别细菌胞壁成分肽聚糖来介导免疫应答信号途径活化发挥重要作用。

Dante Neculai教授团队
近日,浙江大学医学院基础医学系Dante Neculai教授团队研究发现,NLR家族的两个重要受体蛋白NOD1和NOD2能够在棕榈酰转移酶ZDHHC5的作用下发生棕榈酰化修饰,从而介导细菌性炎症信号通路的发生。这一发现有效地连接起科学机理与临床问题,未来在诊断和治疗上或有重要价值。
这项研究,10月25日刊登在国际顶尖杂志《科学》(Science),浙江大学医学院基础医学系2015级博士生陆喦、2017级博士生郑裕萍,加拿大Princess Margaret癌症研究所研究中心博士后?tienne Coyaud,浙江大学医学院基础医学系讲师张超为共同第一作者。浙江大学医学院基础医学Dante Neculai教授、孙启明教授、加拿大Princess Margaret癌症研究所研究中心Brain Raught教授、多伦多St Michael医院Gregory D. Fairn教授为共同通讯作者。
“哨兵”如何在其位谋其政
NOD1和NOD2是炎症性肠病(IBD)的先天性免疫的重要识别受体,作为“哨兵”的模式识别受体,它们各有各的岗位,有的在“城墙”上工作,有的在“城墙”内工作。
很长一段时间,科研人员认为NOD1和NOD2蛋白这两个“哨兵”主要在“城墙”以内的细胞质中工作,通过侦探“敌情”,进而释放炎症因子招募下游的白细胞的吞噬病原菌或者修复受损部位,恢复细胞结构。
随着研究的发展,科学家们发现NOD1和NOD2蛋白不仅在“防火墙”以内,而且还贴着“防火墙”工作。然而NOD1和NOD2蛋白缺乏结合膜结构域,天然与细胞膜“磁场不合”,那它们为什么却能在这里防守呢?科学家们一直在寻找其中的奥秘。
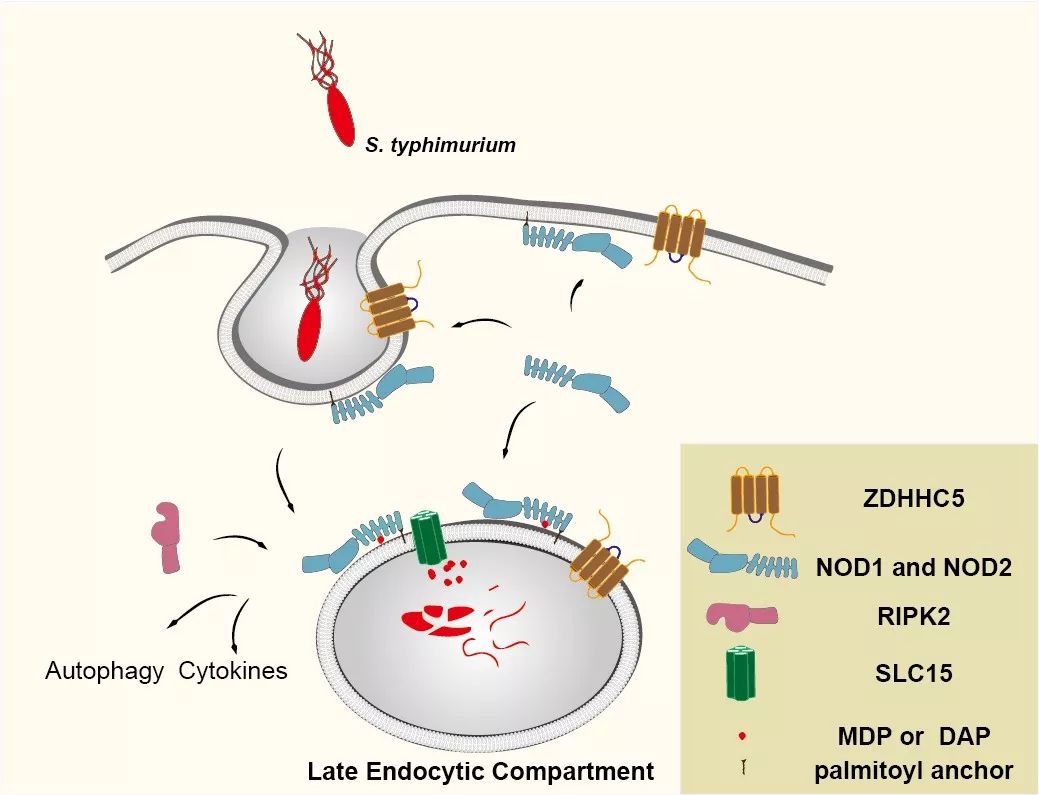
ZDHHC5介导的NOD1/2棕榈酰化在病原细菌感知过程的示意图
Dante Neculai团队的科研人员发现,NOD1和NOD2蛋白通过酯化修饰,把一个16碳的饱和脂肪酸连接到了细胞膜疏水层,这就好像一个“锚”把哨兵固定在城墙内侧。
那么谁给了NOD蛋白这个“锚”呢?科研人员继续破案,发现是棕榈酰化转移酶(ZDHHC5)这个“司令”,把棕榈酰脂肪酸这个“锚”,安放给NOD1和NOD2蛋白这两个“哨兵”。这样,它们就可以老老实实呆在城墙内侧抵御外敌(病原细菌)入侵。
锚定在“城墙”是这么重要
NOD1、NOD2的工作机制是,ZDHHC5受到外来病原菌刺激后,对NOD1、NOD2进行棕榈酰化修饰,进而这两个蛋白可以到膜上工作,介导细菌内吞。随着细胞质联合形成内吞体,内吞体演变成晚期内吞体,之后各种各样的水解酶,把细菌消耗降解,降解成片断后,里面的有效成分可以通过内吞体上的转运体“通道”进入到细胞质中,进一步激活处于细胞质的NOD1、NOD2,激活下游的炎症反应。
在整个炎症通路中,很多科研人员思考的是为什么要到“城墙”工作?

Dante Neculai指导团队成员分析结果
病原物的入侵就如同发生,哨兵看到后,立即向大家报告,才能引来其他细胞一起“救火”。由此可见,作为哨兵的NOD1和NOD2在发现敌情并向下游报告的工作,是整条通路中的重要一环。
“当激活炎症通路后,巨噬细胞就会释放炎症因子,炎症因子能够招募血液中更多的白细胞,去粘附在损伤和入侵部位,进而或修复这个部位,或吃掉病菌。”Dante Necula说,不把NOD蛋白锚定在细胞膜上,就不能有这一连串的反应。要是不钉在细胞膜上,离着八丈远就无法第一时间汇报敌情,从而造成入侵病原的进一步感染,使疾病发生或恶化。原来一直知道“哨兵”定位特殊这个现象,但是不知道是谁让‘哨兵’守护在那里的具体分子机理。”
NOD1和NOD2是天然免疫研究的两个模式分子,可以对病原识别等研究提供了重要的理论和实例借鉴。匿名评审专家表示,该论文显示出作者们的研究工作非常严谨,多条线索阐明了文章主旨。这项研究发现具有很高的创新性,将会病原性免疫反应的领域引起广泛关注。
为什么是ZDHHC5这个“司令”呢?
科研人员顺着细菌进入细胞的两个线路去发掘线索,他们发现,不论是细菌直接入侵,还是通过内吞体间接进入细胞,都会发生棕榈酰化,让NOD1和NOD2带上“锚”,然而棕榈酰转移酶有24个成员,确定哪一个才是真正的目标靶点是工作的重要部分。
科研人员将与NOD1和NOD2有关的互作蛋白都查了一遍,寻找“究竟是谁给了武器”,通过绘制网络,目标聚焦在了ZDHHC5上。而且科研人员还发现,上膜和下膜还是一个循环的过程。ZDHHC5先从细胞中拿到“锚”,然后再转移到NOD1和NOD2身上。当有外敌入侵时,会有更多催化信号。
Dante Neculai教授的团队采用新的蛋白互作质谱联用法(BioID),酰基生物素置换法(ABE)及荧光素酶报告系统,基因敲除鼠等手段,发现NOD1和NOD2的棕榈酰化修饰是影响其亚细胞定位及正确免疫应答功能的关键因素,并鉴定了NOD1和NOD2棕榈酰化的发生位点及相应的棕榈酰转移ZDHHC5。ZDHHC5主要定位于细胞质膜,NOD1、NOD2能够在此被棕榈酰化从而定位于质膜。
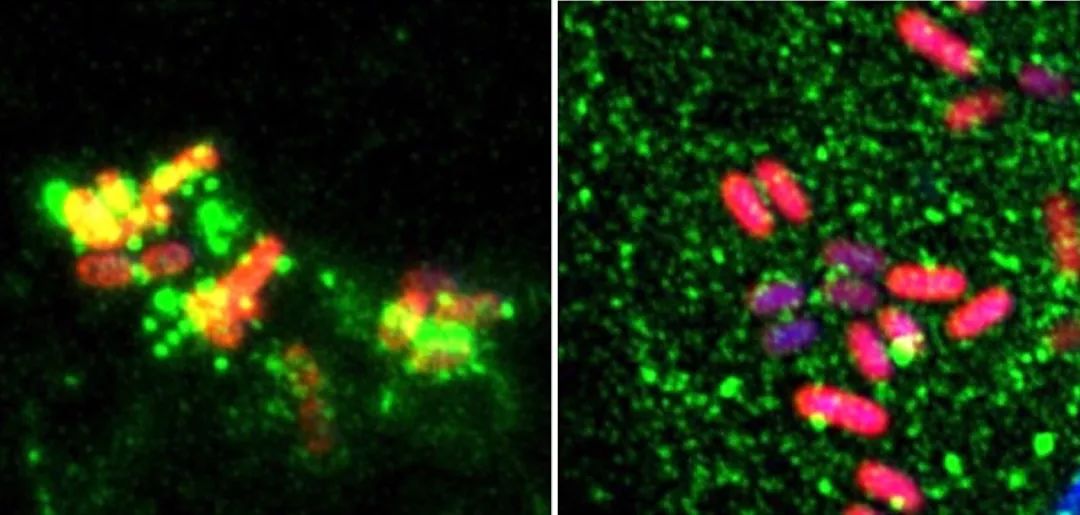
小鼠骨髓巨噬细胞(BMDM)内源NOD1蛋白识别沙门氏菌侵染 野生型BMDM(左), ZDHHC5 敲除型(右)
另外,在沙门氏菌的侵袭下,ZDHHC5 能够被招募于含病原菌的内体膜,从而吸引并修饰胞质内更多NOD1/2,使其定位于内体膜。各种SLC 家族的转运蛋白将病原菌细胞壁中的肽聚糖组分转运至细胞质中(如MDP, DAP),棕榈酰化修饰的NOD1和NOD2能够识别并诱发细胞内NOD1和NOD2介导的免疫应答,从而促使入侵者被自噬降解及宿主细胞炎症因子的释放。
“在全球范围内,肠炎每年会造成成千上万人的死亡。”孙启明表示,目前的发现可以在临床上为遗传性肠炎提供诊断的新标志。未来还有望通过设计治疗方案,开发潜在化合物让蛋白的功能恢复,从而缓解或者治愈炎症性肠病。
该研究受到科技部、国家自然科学基金委、浙江省自然科学基金等项目的资助。除了论文中列出的单位和作者,浙江大学公共科研平台以及刘伟教授和鲁林荣教授等为本项目的顺利完成给予了大力的支持。
文字记者:吴雅兰丨柯溢能
摄影记者:卢绍庆丨部分图片由课题组提供
今日编辑:雷思涵丨佳乐
本文来源:浙大官微编辑:浙江大学校友总会


点个在看,为科学团队点赞