
来源:健康界
作者:张斯文
正文共:2450 字预计阅读时间:7 分钟
浙大医学院学者研究创新了癫痫治疗思路、发现了肠炎诊断新标志。
北京时间10月25日,浙江大学医学院郭江涛课题组、Dante Neculai课题组分别在《科学》杂志刊发长文,阐述在钾-氯共转运蛋白的结构上的重大发现为治疗癫痫提供新思路,以及在机体防御外来病原体和应激物机制上取得的重大突破为遗传性肠炎提供临床诊断新标志。
KCC的门开了,癫痫也就有治了
人体细胞内的钾、钠、氯等离子稳态是受到严格调控的,离子稳态一旦失衡,就会导致高血压、抑郁、癫痫等一系列疾病。
在细胞膜上,有一类被称为阳离子-氯离子共转运蛋白的蛋白质,可以带着离子进入和离开细胞,从而有效调控细胞内的离子稳态。不过长期以来,由于缺乏精确的结构信息,人们对这类蛋白的工作机理还不甚了解。
浙江大学医学院郭江涛课题组解析了这类蛋白质中的一个成员——人源钾-氯共转运蛋白KCC1的2.9埃高分辨率冷冻电镜结构,揭示了钾离子和氯离子的结合位点,提出一个钾-氯共转运机理的模型,这将为相关的疾病治疗和药物设计提供新的视角。
10月25日,这项研究刊登在《科学》(Science)上。浙江大学医学院刘斯博士、冷冻电镜中心常圣海博士和物理系硕士生韩斌铭为文章的共同第一作者。
据郭江涛介绍,受限于钾-氯共转运蛋白的样品获得不易,较小分子量的膜蛋白的高分辨率结构解析一直具有挑战性两方面因素,KCC家族的神秘面纱一直未被揭开。
在浙江大学冷冻电镜中心的300 kv的高性能冷冻电镜Titan Krios助力下,刘斯博士经过大量的蛋白表达和纯化条件的优化,最终获得足够量的可用于冷冻电镜数据收集的KCC1蛋白样品。
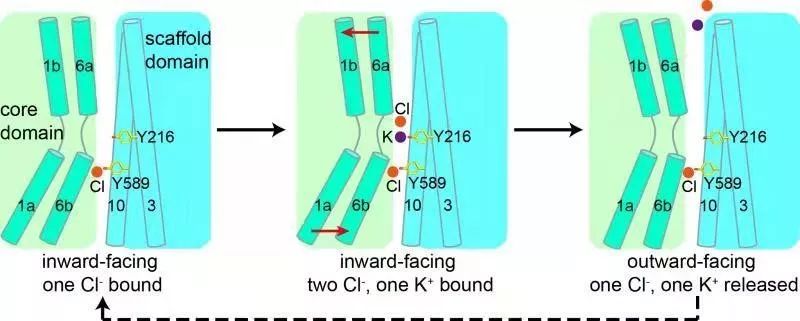
研究人员发现KCC1是以二聚体的形式存在,它的跨膜区与胞外区均参与了二聚体的形成。在KCC1结构中,研究人员鉴定出一个钾离子和两个氯离子的结合位点;结合离子转运实验、分子动力学模拟、结构比较等方法,该研究阐明了KCC1以1:1的比例同时同向转运钾离子和氯离子的分子机理。
“物质的跨膜运输是人体细胞与外界进行物质、能量和信息交换的重要途径”,郭江涛介绍说,“在转运钾离子和氯离子的过程中,KCC1就好像细胞膜上有一个旋转门,朝内这一侧的门先打开,离子结合到KCC1上进入旋转门内;然后朝外这一侧的门打开了,离子从旋转门释放到细胞膜外。”
据了解,KCC1的高分辨率电镜结构的获得,将有助于下一步设计针对KCC的药物,为治疗癫痫等疾病提供帮助。
两个蛋白在其位,有助肠炎被治愈
近日,浙江大学医学院基础医学系Dante Neculai教授团队研究发现,NLR家族的两个重要受体蛋白NOD1和NOD2能够在棕榈酰转移酶ZDHHC5的作用下发生棕榈酰化修饰,从而介导细菌性炎症信号通路的发生。
NOD1和NOD2是炎症性肠病(IBD)的先天性免疫的重要识别受体,作为“哨兵”的模式识别受体,它们各有各的岗位,有的在“城墙”上工作,有的在“城墙”内工作。
Dante Neculai团队的科研人员发现,NOD1和NOD2蛋白通过酯化修饰,把一个16碳的饱和脂肪酸连接到了细胞膜疏水层,这就好像一个“锚”把哨兵固定在城墙内侧。棕榈酰化转移酶(ZDHHC5)这个“司令”,把棕榈酰脂肪酸这个“锚”,安放给NOD1和NOD2蛋白这两个“哨兵”。这样,它们就可以老老实实呆在城墙内侧抵御外敌(病原细菌)入侵。
也就是说,ZDHHC5受到外来病原菌刺激后,对NOD1、NOD2进行棕榈酰化修饰,进而这两个蛋白可以到膜上工作,介导细菌内吞。随着细胞质联合形成内吞体,内吞体演变成晚期内吞体,之后各种各样的水解酶,把细菌消耗降解,降解成片断后,里面的有效成分可以通过内吞体上的转运体“通道”进入到细胞质中,进一步激活处于细胞质的NOD1、NOD2,激活下游的炎症反应。
Dante Neculai教授的团队采用新的蛋白互作质谱联用法(BioID),酰基生物素置换法(ABE)及荧光素酶报告系统,基因敲除鼠等手段,发现NOD1和NOD2的棕榈酰化修饰是影响其亚细胞定位及正确免疫应答功能的关键因素,并鉴定了NOD1和NOD2棕榈酰化的发生位点及相应的棕榈酰转移ZDHHC5。ZDHHC5 主要定位于细胞质膜,NOD1、NOD2 能够在此被棕榈酰化从而定位于质膜。
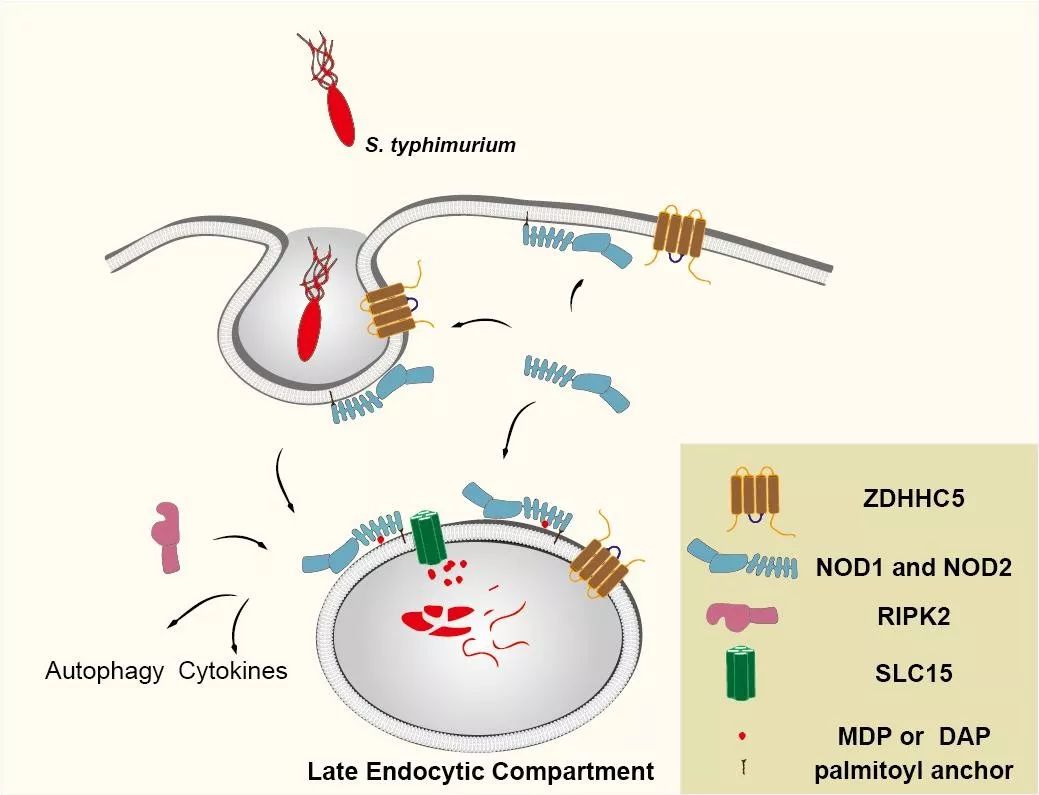
另外,在沙门氏菌的侵袭下,ZDHHC5 能够被招募于含病原菌的内体膜,从而吸引并修饰胞质内更多NOD1/2,使其定位于内体膜。各种 SLC 家族的转运蛋白将病原菌细胞壁中的肽聚糖组分转运至细胞质中(如MDP, DAP),棕榈酰化修饰的 NOD1和NOD2能够识别并诱发细胞内NOD1和NOD2介导的免疫应答,从而促使入侵者被自噬降解及宿主细胞炎症因子的释放。
“在全球范围内,肠炎每年会造成成千上万人的死亡。”浙江大学医学院基础医学系孙启明教授表示,目前的发现可以在临床上为遗传性肠炎提供诊断的新标志。未来还有望通过设计治疗方案,开发潜在化合物让蛋白的功能恢复,从而缓解或者治愈炎症性肠病。
刊登在《科学》(Science)上的这项研究,由浙江大学医学院基础医学系博士生陆喦、郑裕萍,加拿大Princess Margaret癌症研究所研究中心博士后?tienne Coyaud,浙江大学医学院基础医学系讲师张超为共同第一作者。浙江大学医学院基础医学Dante Neculai教授、孙启明教授,加拿大Princess Margaret癌症研究所研究中心Brain Raught教授,多伦多St Michael医院Gregory D. Fairn教授为共同通讯作者。
(文中资料由课题组提供)
热门推荐
“封针”疗法治脑瘫,是创新还是骗局?孕妇压力大不容易生男孩?靠谱吗?孙立忠:我在哪儿,就要让胸腹主动脉瘤消失在哪儿消逝在马拉松赛道上的生命,跑马真的危险么?
版权声明
注:本文系原创,欢迎转发朋友圈
微信公众号或媒体转载请联系健康界
文章转载,请关注“健康界”公众号
更多精彩内容,点击“阅读原文”成为健康界VIP,来《看健日报》一探究竟!?百万医健人士,都在看?