
近期北京大学-清华大学生命科学联合中心邓宏魁研究组、首都医科大学附属北京佑安医院吴昊研究组以及解放军总医院第五医学中心陈虎课题组发表了一篇研究论文。该研究论文的发表,意味着中国科研人员建立了基于CRISPR在人成体造血干细胞上进行CCR5基因编辑的技术体系,实现了经基因编辑后的成体造血干细胞在人体内长期稳定的造血系统重建。

激动人心!中国科研人员首次完成基因编辑干细胞治疗艾滋病和白血病患者

吴昊教授(左)与团队成员在实验中 图片来源于网络北京大学-清华大学生命科学联合中心邓宏魁研究组、首都医科大学附属北京佑安医院吴昊研究组以及解放军总医院第五医学中心陈虎课题组在《新英格兰医学杂志》(The New England Journal of Medicine)发表了题为《利用CRISPR基因编辑的成体造血干细胞在患有艾滋病合并急性淋巴细胞白血病患者中的长期重建》(CRISPR-Edited Stem Cells in a Patient with HIV and Acute Lymphocytic Leukemia)的研究论文。
这意味着中国科研人员首次完成基因编辑干细胞治疗艾滋病和白血病患者。
发现“治愈”艾滋病重要新策略
自20世纪80年代以来,艾滋病造成了重大的公共卫生问题和社会问题。1996年,艾滋病领域研究取得了里程碑式进展,HIV入侵T细胞的主要共受体CCR5被发现,北大教授邓宏魁是主要发现者之一。
随后的研究发现,CCR5基因呈缺陷型(CCR5-Δ32)的人群不会被R5嗜性HIV病毒感染。
该研究论文的发表,意味着中国科研人员建立了基于CRISPR在人成体造血干细胞上进行CCR5基因编辑的技术体系,实现了经基因编辑后的成体造血干细胞在人体内长期稳定的造血系统重建,同时,在成体造血干细胞上的基因编辑并不会对其他组织器官及生殖系统产生影响。该工作初步证明了基因编辑的成体造血干细胞移植的可行性和在人体内的安全性,将会促进和推动基因编辑技术在临床应用领域的发展。
研究组致力突破临床应用瓶颈
2007年,一名同时患有白血病和艾滋病的“柏林病人”在接受具有CCR5-Δ32突变的造血干细胞移植后,血清中的HIV病毒得到有效清除,实现了艾滋病的“功能性治愈”。
因此,通过基因编辑敲除成体造血干细胞上CCR5基因,再将编辑后的细胞移植到艾滋病患者体内有可能成为“功能性治愈”艾滋病的新策略。如何在造血干细胞中进行高效基因编辑,一直是该领域实现临床应用的关键瓶颈。
2017年,邓宏魁研究组建立了利用CRISPR/Cas9进行人造血干细胞基因编辑的技术体系。经过基因编辑后的人造血干细胞在动物模型中长期稳定地重建人的造血系统,其产生的外周血细胞具有抵御HIV感染的能力,该研究成果发表在《Molecular Therapy》(美国基因与细胞治疗协会旗下期刊)上。为了实现该技术在临床上的应用,在此基础上进行了一系列的优化。

提供适配骨髓
据了解,CRISPR/Cas9系统是一种存在于古细菌中的针对入侵病毒和质粒的适应性免疫系统,可通过其gRNA定位于DNA靶序列上的PAM,直接与DNA靶标碱基配对对目标基因进行剪切以形成DSB,随后启动机体的自我损伤修复机制,并产生敲入或敲除的效应。
该研究艾滋病患者合并急性淋巴细胞白血病,在接受ART和化疗之后,研究人员在中华骨髓库中筛选适配骨髓,在CD34+ HSPC细胞进行CCR5基因的CRISPR编辑(达到17.8%的CCR5基因敲除效率)之后回输到患有白血病合并艾滋病的患者体内,并进行了长达近两年的移植重建及基因编辑效果的评价。
研究发现,在移植后4周,患者白血病处于完全缓解状态,供者型骨髓细胞嵌合率达100%。经过长达19个月的随访发现,患者白血病处于持续完全缓解状态,供者型细胞完全嵌合,骨髓细胞中能够持续检测到CCR5基因编辑。为了初步探索治疗的有效性,对该患者短暂停止服用抗HIV病毒药物。在短暂停药期间,CCR5基因编辑的T细胞表现出一定程度抵御HIV感染的能力,在19个月的观察中并未发现基因编辑造成的脱靶及其他副作用。结果表明,基于CRISPR的成体造血干细胞基因编辑技术能够在患者体内实现长期稳定的基因编辑效果,经过编辑后的成体造血干细胞能够长期重建人的造血系统。
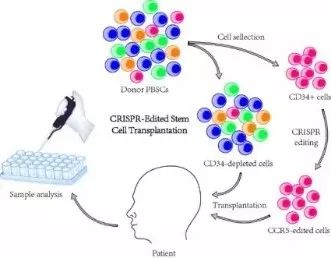
本研究针对基因编辑安全性和有效性进行了一系列的优化,首次在人体内探索了基因编辑的造血干细胞移植的可行性和安全性,对于推动基因编辑技术治疗多种疾病的临床研究具有重要参考价值和临床意义。
项目获北京及国家相关基金支持
据了解,在成体造血干细胞上的基因编辑只局限在造血干细胞及其分化产生的血细胞中,而不会对其他组织器官及生殖系统产生影响。以CRISPR为代表的基因编辑技术在疾病的治疗上具有极大的应用潜力,有望为艾滋病、镰刀型贫血、血友病、β地中海贫血等血液系统相关疾病的治疗带来新的曙光。
研究团队表示,在今后的研究中,将进一步提高基因编辑效率及优化移植方案,有望加速基因编辑造血干细胞移植技术向临床疾病治疗转化的进程。
传递医学知识,共享临床资料

版权声明:凡本平台转载的所有的文章 、图片、音频、视频文件等资料均来自网络,版权归原作者所有。不希望被转载的原作者及老师可与我们联系,我们将立即进行删除处理。